818号令《生物医学新技术临床研究和临床转化应用管理条例》落地,明确“三甲医院可开展规范化细胞研究”,为细胞治疗及临床转化按下了加速键。这意味着生物制药企业和医院在应用新技术时,需要严格遵守政策、伦理和管理规范。因此,在选择一次性生物医疗耗材(如细胞培养袋、冻存袋)时,生物制药企业和医院更关注产品的安全性、可追溯性及批次稳定性,拥有ISO13485、ISO9001、药包材登记号和GMP洁净车间生产环境等资质的产品,将为生物制药企业和医院提供可靠保障。
生物制药企业和医院关注耗材质量的原因
1.确保临床研究和转化安全可控
-
一次性生物医疗耗材(如细胞培养袋、冻存袋)直接参与细胞制备、培养、冻存及输注等关键环节;
-
高质量耗材可以降低实验误差、交叉污染和操作风险,保障患者和受试者安全。
2.满足政策与合规要求
-
生物制药企业和医院在开展细胞研究和转化应用时,需要遵循GMP生产环境、ISO13485、 ISO9001、药包材登记号等规范;
-
使用具有完整质量证书的国产耗材(如冻存袋、细胞培养袋),可以满足监管部门和院内审查的合规性要求。
3.保证批次稳定性与实验可重复性
-
细胞研究和治疗需要耗材(如冻存袋、细胞培养袋)性能一致、批次稳定;
-
可追溯的质量体系可以让生物制药企业和医院在长期使用中保持实验结果和治疗效果的一致性。
4.降低供应风险,确保连续性
-
818号令加速了临床转化进程,生物制药企业和医院需要稳定、可持续的耗材供应以支持研究和治疗;
-
标准化生产和规模化供应能力是生物制药企业和医院选择耗材(冻存袋、细胞培养袋)的重要考虑因素。
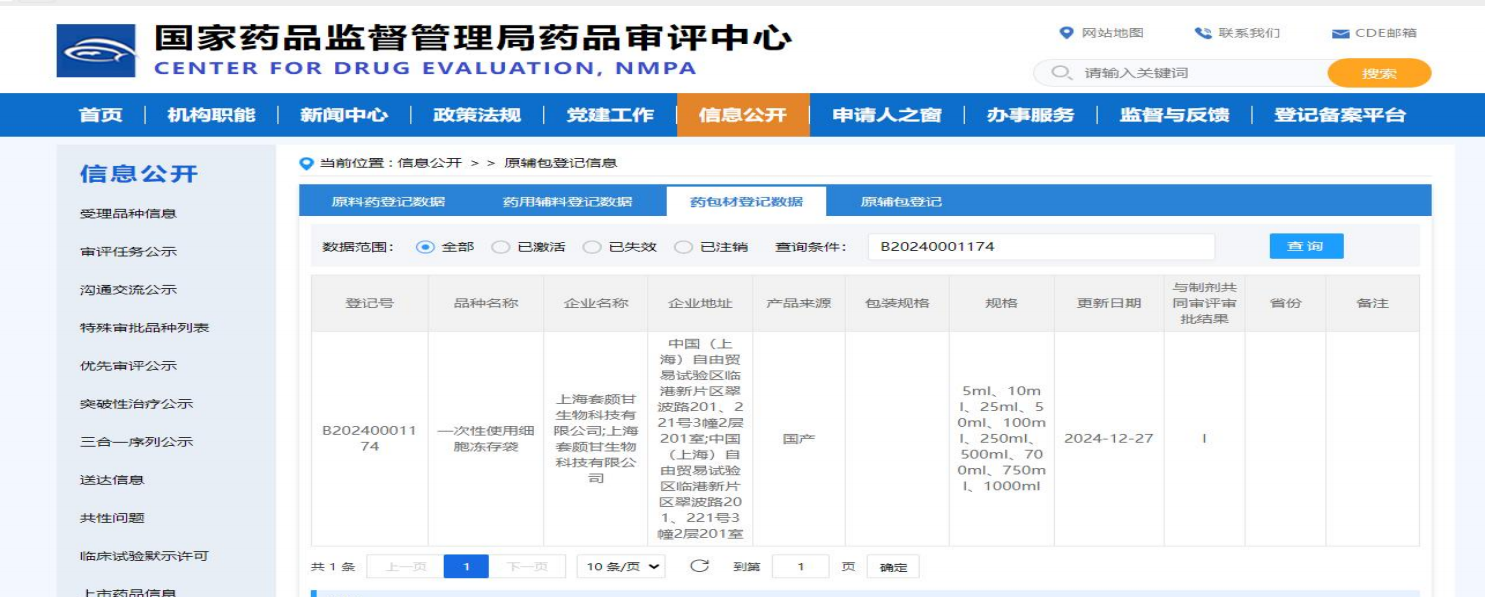
818号令不仅为生物制药企业和医院开展细胞研究提供了政策支撑,也提高了生物制药企业和医院对耗材(冻存袋、细胞培养袋)安全性、合规性和稳定性的关注度。选择具有认证资质、质量可控(ISO13485、ISO9001、药包材登记号B20240001174 、2000㎡C+A级GMP洁净车间)的国产耗材,已成为生物制药企业和医院确保临床研究顺利开展的关键保障。
我公司依托 ISO13485、ISO9001 质量管理体系认证、药包材登记号 B20240001174、以及2000㎡ C+A 级 GMP 洁净车间和完善的标准化管理体系,形成了从研发、生产到质量控制的全流程保障。凭借稳固的质量基础和规范化管理,我公司成为了国内生物制药企业和多家三甲医院值得信赖的战略合作伙伴。
ISO认证证书

药包材登记号:B20240001174